全球首创的“温江造”创新药迎来新进展→

1月6日,记者从四川百利天恒药业股份有限公司(以下简称“百利天恒”)获悉,其自主研发的EGFRxHER3双抗ADC iza-bren(BL-B01D1)的一项新增适应症已被国家药品监督管理局药品审评中心纳入优先审评程序,适应症为既往经PD-1/PD-L1单抗联合含铂化疗治疗失败的复发性或转移性食管鳞癌。
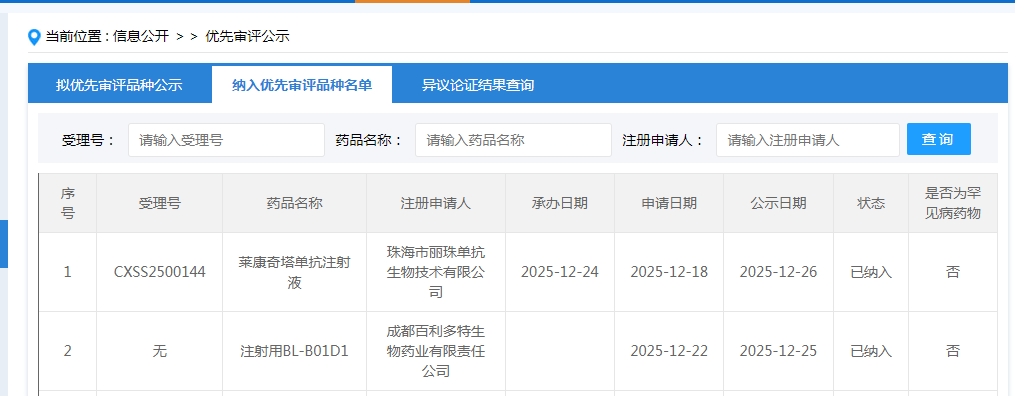
这是iza-bren(BL-B01D1)第二项被纳入优先审评程序的适应症。
为鼓励研究和创制新药,国家药品监督管理局规定在药品上市许可申请时,具有明显临床价值的药品可以申请适用优先审评审批程序。
2025年9月5日,iza-bren(BL-B01D1)的首个适应症晚期鼻咽癌被国家药品监督管理局药品审评中心纳入优先审评;
2025年11月21日,该适应症的上市申请成功获得受理。

本次iza-bren(BL-B01D1)被纳入优先审评,基于iza-bren(BL-B01D1)在食管鳞癌的III期临床试验在期中分析中达到无进展生存期(PFS)和总生存期(OS)双主要终点。这也是全球首个ADC药物在食管癌治疗中取得无进展生存期(PFS)和总生存期(OS)双阳性结果的III期临床研究。

截至目前,iza-bren(BL-B01D1)已获得国家药品监督管理局药品审评中心的7项突破性疗法认定,以及美国食品药品管理局的1项突破性疗法认定。
作为一家在肿瘤大分子治疗领域(ADC/GNC/ARC)具备全球领先的创新研发能力、全球临床开发和规模化生产供应能力的综合型生物医药企业,新的一年,百利天恒将继续聚焦全球生物医药前沿领域,加快推动创新药研发进程和全球化布局。

记者:陈思洋 王戎
编辑:彭棣 李林波
审核:高舒婷


评论